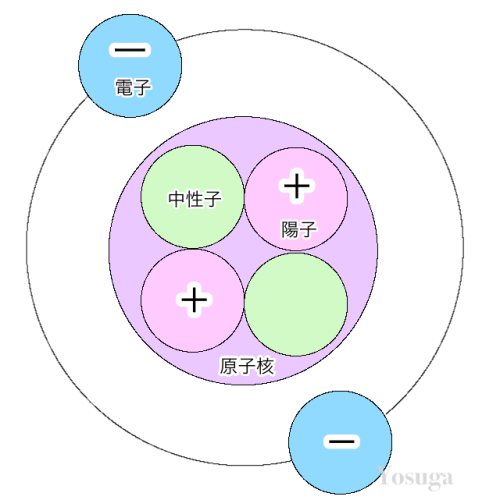
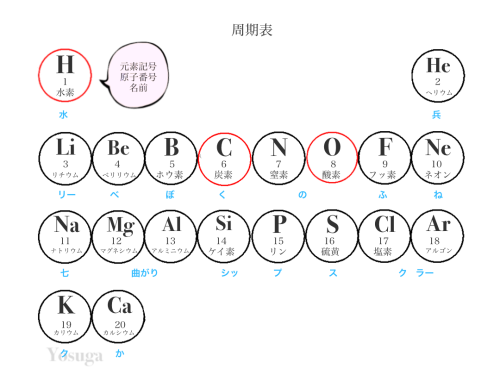
前回で、原子はなぜ結合するのか。は、わかりましたね!
今回は、どうやって結合しているのか? です!!
原子が結合する方法は3種類あります。
それが【イオン結合】【金属結合】【共有結合】です。
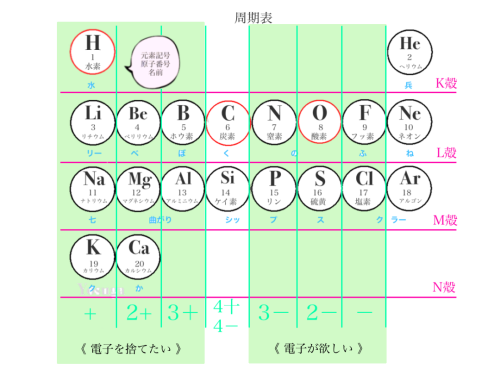
イオン結合
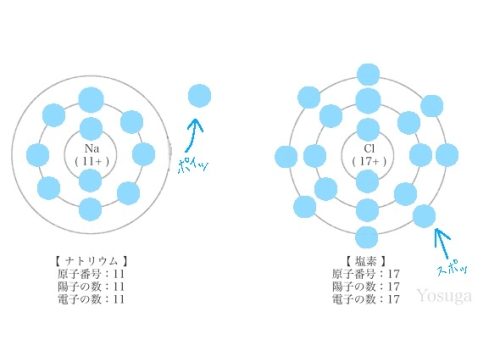
イオン結合は、電子を捨てたい原子と、欲しい原子の結合です。
金属結合
金属結合は、電子を捨ててたい原子同士の結合です。
捨てたい原子同士なので、電子を ”押し付け合う” イメージですね。
共有結合
香り成分をつくる芳香分子は、共有結合がメインとなります。
共有結合は、電子が欲しい原子同士の結合です。
結合するときに、欲しい数の電子分の「手」伸ばして “取り合う” イメージです。
そして結合のときに何本の手が出ているかで、結合の名前が変わります。
単結合
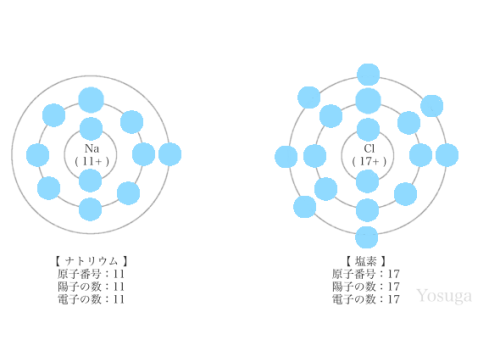
塩素(Cl)の原子番号は「17」です。
なので、電子の数は17個。
K殻に2個。L殻に8個。M殻7個あります。
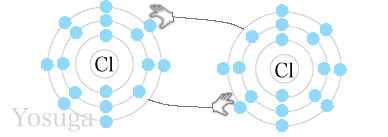
塩素同士の結合は、電子が1個足りず、2個を取り合っています。
原子から手が1本ずつ出ていますね。
これが、単結合です。
二重結合
酸素(O)の原子番号は「8」です。
なので、電子の数は8個。
K殻に2個。L殻に6個あります。
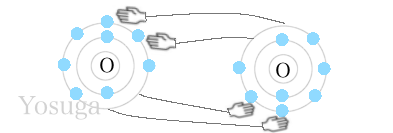
酸素同士の結合は、電子が2個足りず、4個を取り合っています。
手が2本ずつ出ているのが、二重結合です。
三重結合
窒素(N)の原子番号は「7」です。
なので、電子の数は7個。
K殻に2個。L殻に5個あります。
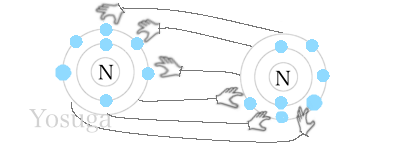
窒素同士の結合は、電子が3個足りず、6個を取り合っています。
手が3本ずつ出ているのが、三重結合です。
Q
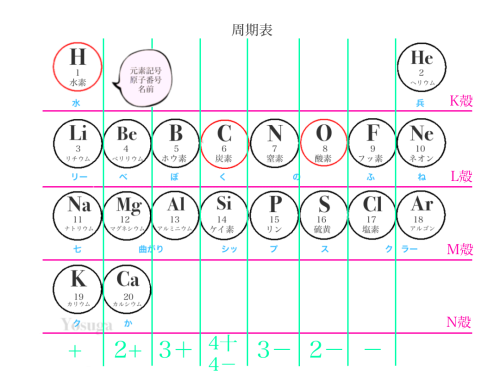
では、芳香成分のメインである水素・炭素・酸素
それぞれの電子の数、電子がどの位置に何個あるのか、手の本数を考えてみましょう!!
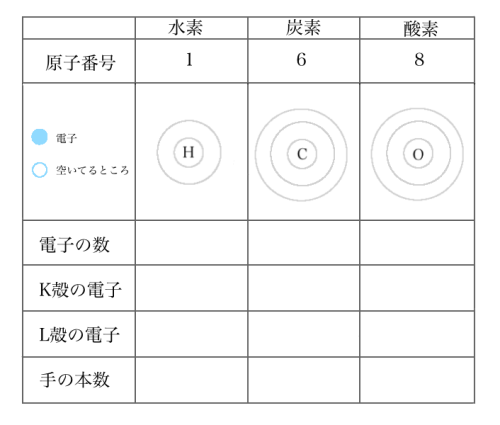
・
・
・
・
・
・
A

正解できましたか??
水素・炭素・酸素の手の本数は、暗記しておくのもいいですね😊