身の回りにある物質は、すべて原子が集まってできたものでしたね!
なぜ原子は集まっているんでしょう??
原子は、”安定したい!” と思っています。
なので原子はいくつも集まって、分子になるんですね!
+の電気を帯びている陽子。ーの電気を帯びている電子。
陽子と陽子、電子と電子が隣り合うと、反発しあってしまいます。
陽子同士の反発は、中性子が接着剤の役割をしてくれていました。
電子の場合は、居場所を変えることで、反発しないようにしています。
その居場所の名前が「殻」です。

それぞれの殻は、定員数が決まっています。
K殻とL殻は、満員になってから、次の殻に移動します。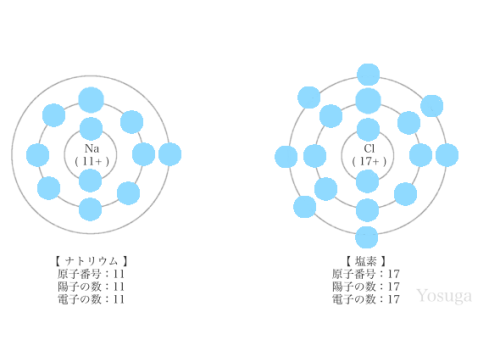
ナトリウムの電子の数は「11個」です。
電子は、K殻に2個(満員)、L殻に8個(満員)、M殻に1個です。
電子同士の反発を起こさないように、殻の場所を変えています。
塩素の電子の数は「17個」です。
なので、K殻に2個(満員)、L殻に8個(満員)、M殻に7個の電子があります。
ナトリウムと塩素の電子をずっと見てると、ムズムズしてきませんか?
ナトリウムは1個だけ飛び出ちゃってるし、塩素は1個足りてないし。
電子が1個出ていったり、1個入ってくれたら、キレイに収まるのにな〜
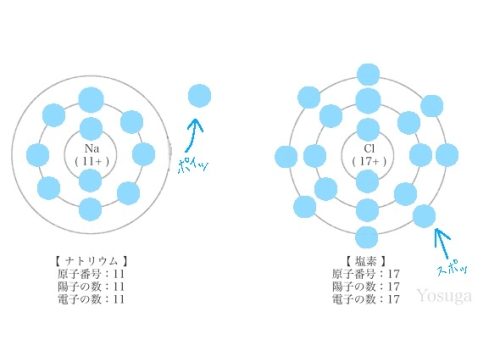
って思いましたか???
電子がキレイに収まっている状態を「安定している」と表現します。
原子は、この安定を求めて、原子同士でくっついて(結合して)分子になるんですね。
ナトリウムは1個減ってキレイになった状態を【Na+】と表現します。
そして【Na+】は陽イオンです。
塩素は1個増えてキレイになった状態を【Cl−】と表現します。
【Cl−】は陰イオンです。
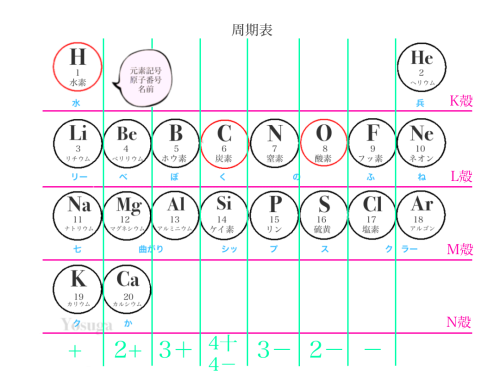
電子がいる一番外側の殻を「最外殻電子」と言います。
この最外殻電子がどの殻なのか。そして、後何個でキレイになるのか。
それは周期表を見ればわかります。
原子はなぜくっつく(結合する)のか。は
なんとなくわかりましたか??
次は、原子同士で結合する方法についてです!!
つづく